อิเล็กโทรเนกาติวิตี
เมื่ออะตอมของธาตุต่างชนิดรวมตัวเป็นโมเลกุลโดยใช้อิเล็กตรอนคู่ร่วมกัน นิวเคลียสของอะตอมทั้งสองจะดึงดูดอิเล็กตรอนคู่ที่ใช้ร่วมกันด้วยแรงที่ต่าง กัน ทำให้อะตอมที่สามารถดึงดูดอิเล็กตรอนได้ดีกว่าเกิดสภาพอำนาจไฟฟ้าค่อนข้าง เป็นลบ ส่วนอะตอมที่ดึงดูดอิเล็กตรอนได้น้อยกว่าจะเกิดสภาพอำนาจไฟฟ้าค่อนข้างเป็น บวก ความสามารถของอะตอมในการดึงดูดอิเล็กตรอนในโมเลกุลของสารเรียกว่า อิเล็กโทรเนกาติวิตี เขียนย่อเป็น EN ตัวอย่างเช่น ในโมเลกุล HCI เนื่องจาก CI ดึงดูดอิเล็กตรอนได้ดีกว่า H ดังนั้น CI จึงมีค่าอิเล็กโทรเนกาติวิตีสูงกว่า H ในโมเลกุล OF2 เนื่องจาก F ดึงดูดอิเล็กตรอนได้ดีกว่า O ดังนั้น F จึงมีค่าอิเล็กโทรเนกาวิตีสูงกว่า O แนวโน้มค่าอิเล็กโทรเนกาติวิตีของธาตุในตารางธาตุเป็นดังนี้
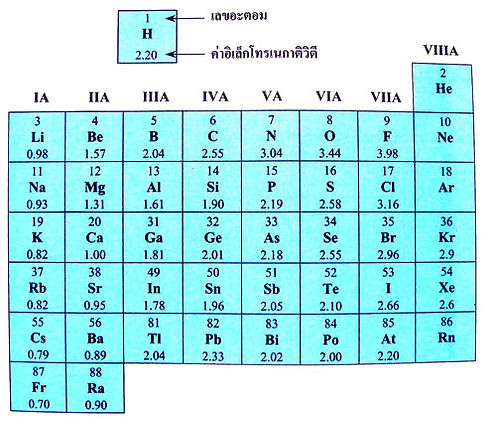
ค่าอิเล็กโทรเนกาติวิตีของธาตุในตารางธาตุ
เมื่อพิจารณาค่าอิเล็กโทรเนกาติวิตีของธาตุในคาบเดียวกัน พบว่ามีแนวโน้มเพิ่มขึ้นตามเลขอะตอม เนื่องจากในคาบเดียวกันอะตอมของธาตุหมู่ IA ความสามารถในการดึงดูดอิเล็กตรอนตามคาบจึงเพิ่มขึ้นจากหมู่ IA ไปหมู่ VIIA ดังนั้นในคาบเดียวกันธาตุหมู่ IA จึงมีค่าอิเล็กโทรเนกาติวิตีต่ำที่สุดส่วนธาตุหมู่ VIIA มีค่าอิเล็กโทรเนกาติวิตีสูงที่สุด
ธาตุในหมู่เดียวกันมีแนวโน้มของค่าอิเล็กโทรเนกาติวิตีลดลงเมื่อเลขอะตอม เพิ่มขึ้น เนื่องจากขนาดของอะตอมที่เพิ่มขึ้นตามหมู่ เป็นผลให้ความสามารถในการดึงดูดอิเล็กตรอนลดลงตามหมู่ด้วย